Page 66 - Хими
P. 66
ХИЧЭЭЛ, СУРГАЛТЫН ҮР ДҮНГ ҮНЭЛЭХ ШАЛГУУР
ХОЁРДУГААР БҮЛЭГ. XI АНГИ (заавал судлах)
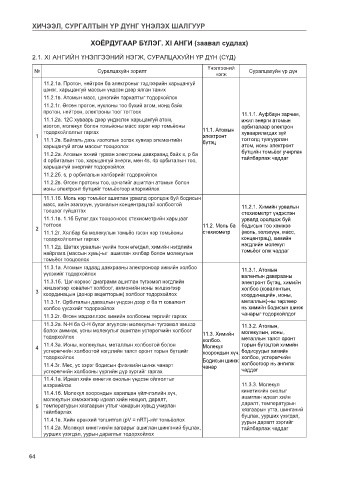
2.1. XI АНГИЙН ҮНЭЛГЭЭНИЙ НЭГЖ, СУРАЛЦАХУЙН ҮР ДҮН (СҮД)
Үнэлгээний
№ Суралцахуйн зорилт нэгж Суралцахуйн үр дүн
11.2.1а. Протон, нейтрон ба электроныг тэдгээрийн харьцангуй
цэнэг, харьцангуй массын үндсэн дээр ялган таних
11.2.1в. Атомын масс, цэнэгийн тархалтыг тодорхойлох
11.2.1г. Өгсөн протон, нуклоны тоо бүхий атом, ионд байх
протон, нейтрон, электроны тоог тогтоох 11.1.1. Ауфбаун зарчим,
11.1.2а. 12С хуваарь дээр үндэслэн харьцангуй атом, ижил энерги атомын
изотоп, молекул болон томьёоны масс зэрэг нэр томьёоны орбиталаар электрон
тодорхойлолтыг гаргах 11.1. Атомын хуваарилагдах зүй
1 электронт
11.1.2в. Байгаль дахь изотопын эзлэх хувиар элементийн бүтэц тогтолд тулгуурлан
харьцангуй атом массыг тооцоолох атом, ионы электронт
11.2.2а. Атомын эхний гурван электроны давхраанд байх s, p ба бүтцийн томьёог учирлан
d орбиталын тоо, харьцангуй энерги, мөн 4s, 4p орбиталын тоо, тайлбарлаж чаддаг
харьцангуй энергийг тодорхойлох
11.2.2б. s, p орбиталын хэлбэрийг тодорхойлох
11.2.2в. Өгсөн протоны тоо, цэнэгийг ашиглан атомын болон
ионы электронт бүтцийг томьёогоор илэрхийлэх
11.1.1б. Моль нэр томьёог ашиглан урвалд оролцож буй бодисын
масс, хийн эзэлхүүн, уусмалын концентрацтай холбоотой 11.2.1. Химийн урвалын
тооцоог гүйцэтгэх стехиометрт үндэслэн
11.1.1в. 1.1б Бүлэг дэх тооцооноос стехиометрийн харьцааг урвалд оролцож буй
тогтоох 11.2. Моль ба бодисын тоо хэмжээ
2
11.1.2г. Хялбар ба молекулын томьёо гэсэн нэр томьёоны стехиометр (моль, эзлэхүүн, масс,
тодорхойлолтыг гаргах концентрац), химийн
11.1.2д. Шатах урвалын үеийн тоон өгөгдөл, химийн нэгдлийн нэгдлийн молекул
найрлага (массын хувь)-ыг ашиглан хялбар болон молекулын томьёог олж чаддаг
томьёог тооцоолох
11.3.1а. Атомын гадаад давхрааны электроноор химийн холбоо 11.3.1. Атомын
үүсэхийг тодорхойлох валентын давхрааны
11.3.1б. ‘Цэг-хэрээс’ диаграмм ашиглан түгээмэл нэгдлийн электронт бүтэц, химийн
жишээгээр ковалент холбоог, аммонийн ионы жишээгээр холбоо (ковалентын,
3 координацын (донор акцепторын) холбоог тодорхойлох координацийн, ионы,
11.3.1г. Орбиталын давхцлын үндсэн дээр σ ба π ковалент металлын)-ны төрлөөр
холбоо үүсэхийг тодорхойлох нь химийн бодисын шинж
11.3.2г. Өгсөн мэдээллээс химийн холбооны төрлийг гаргах чанарыг тодорхойлдог
11.3.2а. N-H бa O-H бүлэг агуулсан молекулын түгээмэл жишээ 11.3.2. Атомын,
болох аммиак, усны молекулыг ашиглан устөрөгчийн холбоог молекулын, ионы,
тодорхойлох 11.3. Химийн металлын талст оронт
холбоо.
4 11.4.3а. Ионы, молекулын, металлын холбоотой болон Молекул торын бүтэцтэй химийн
устөрөгчийн холбоотой нэгдлийн талст оронт торын бүтцийг хоорондын хүч. бодисуудыг химийн
тодорхойлох Бодисын шинж холбоо, устөрөгчийн
11.4.3г. Мөс, ус зэрэг бодисын физикийн шинж чанарт чанар холбоогоор нь ангилж
устөрөгчийн холбооны үүргийн дүр зургийг гаргах чаддаг
11.4.1а. Идеал хийн кинетик онолын үндсэн ойлголтыг
илэрхийлэх 11.3.3. Молекул
11.4.1б. Молекул хоорондын харилцан үйлчлэлийн хүч, кинетикийн онолыг
молекулын хэмжээгээр идеал хийн нөхцөл, даралт, ашиглан идеал хийн
5 температурын хязгаарын утгыг чанарын хувьд учирлан даралт, температурын
тайлбарлах хязгаарын утга, шингэний
буцлах, уурших үзэгдэл,
11.4.1в. Хийн ерөнхий тэгшитгэл (pV = nRT)-ийг томьёолох уурын даралт зэргийг
11.4.2а. Молекул кинетикийн загварыг ашиглан шингэний буцлах, тайлбарлаж чаддаг
уурших үзэгдэл, уурын даралтыг тодорхойлох
64